
Během procesu buněčné meiózy, která je nezbytná pro sexuální rozmnožování, dochází ke vzniku zlomů DNA a jejich následné opravě. PARG-1 je klíčový regulátor tohoto procesu, který hraje roli při udržování integrity genomu, a jeho studium může přinést relevantní poznatky pro lidské zdraví.

Díky výzkumu podpořenému Grantovou agenturou ČR (GA ČR) zkoumal Nicola Silva z Masarykovy univerzity složitosti dynamiky oprav DNA v zárodečné linii.
Lidské buňky se skládají z 46 chromozomů, z nichž polovina je přijata od matky a druhá polovina od otce. Všechny sexuálně se rozmnožující organismy prochází procesem meiózy, při které se počet chromozomů v nově vzniklých pohlavních buňkách, spermiích a vajíčkách, sníží na polovinu. Po oplodnění se genetická informace nesená vajíčkem a spermií spojí do zygoty, čímž dojde k obnovení původního počtu chromozomů.
V průběhu meiózy existuje několik mechanismů, které zajišťují, že obě gamety, tedy spermie a vajíčko, obdrží správný počet chromozomů. Pokud je proces chybný, vede k tvorbě dysfunkčních gamet, které mohou vést k přenosu dědičných mutací na potomky.
Jedním z klíčových aspektů meiózy je výměna částí DNA u každého páru mateřských a otcovských homologních chromozomů v procesu nazývaném homologní rekombinace. V procesu zvaném crossover dojde ke vzniku takzvaných dvouřetězcových zlomů DNA (DSB z anglického double-strand breaks), mateřské a otcovské chromozomy se spojí a vymění si navzájem odpovídající části DNA sekvence. Díky crossoveru dochází přeuspořádání genetické informace v dceřiných buňkách a vzniku genetické rozmanitosti.
Počet zlomů vzniklých během meiózy v pohlavních buňkách je ovšem výrazně vyšší než počet crossoverů, což naznačuje, že opravné systémy, které využívají homologní sekvence k obnovení integrity genomu, se také podílejí na opravě zlomů, které ke crossoveru nevedou.
Přísná regulace počtu dvouřetězcových zlomů DNA
Přerušení řetězce DNA představuje nebezpečí z hlediska zachování integrity genomu, a proto musí být jejich počet, umístění i aktivace DNA opravných systémů, pečlivě regulovány. Vědci již identifikovali řadu genů, které jsou zodpovědné za procesy opravy DNA. Mutace v jakémkoliv z těchto opravných genů mohou u lidí výrazně zvýšit riziko vzniku nádorových onemocnění. Příkladem mohou být geny BRCA1/BRCA2, jejichž mutace je spojována se zvýšeným rizikem rakoviny prsu a vaječníků nebo Fanconiho anémií.
Jednou z cest, jakými je možné kontrolovat opravy DNA, je připojení chemických skupin k proteinu po jeho syntéze nebo odstranění signálních peptidů po buněčné lokalizaci v procesu nazývaném post-translační modifikace. Jednou z hlavních změn, ke kterým dochází v odpovědi na poškození DNA, je poly-ADP-ribosylace (PARylace), proces, při kterém jsou na substráty přidány jednotky ADP-ribózy, což vede k regulaci jejich aktivity. Ačkoli byla PARylace rozsáhle studována na výzkumných modelech ex vivo, její studium v živém savčím organismu je obtížné kvůli embryonální letalitě spojené s mutací, která vede k úplné ztrátě funkce u jejích „zapisovatelů“, PARP1/2. Tyto enzymy jsou zodpovědné za syntézu řetězců ADP-ribózy v reakci na genotoxický stres. In vivo studium také komplikuje enzym „vymazávač“ PARG, který působí proti aktivitě PARP1/2 tím, že rozkládá řetězce ADP-ribózy.
Hlístice Caenorhabditis elegans, která je často využívaná jako modelový organismus pro studium stability genomu, poskytuje obrovskou výhodu ve srovnání s jinými modelovými organismy, protože toleruje mutace, které vedou k zániku funkčnosti genů PARP1/2 i PARG, což umožňuje studium jejich funkce v zárodečné linii.
Nicola Silva z Biologického ústavu Lékařské fakulty Masarykovy univerzity díky projektu financovanému GA ČR provedl podrobnou in vivo analýzu rolí, kterou tyto proteiny plní, což vedlo k identifikaci jejich klíčových funkcí, zejména PARG-1 (homolog savčího PARG u C. elegans) během meiózy.
Díky využití technik úprav genomu (CRISPR) byli výzkumníci schopni lokalizovat pozici PARG-1 při vývoji vajíček. Jejich analýza odhalila, že PARG-1 je nedílnou součástí důležité meiotické proteinové struktury, která udržuje chromozomy pevně spojené během meiózy a nazývá se Synaptonemální komplex (SC), viz Obrázek 1.
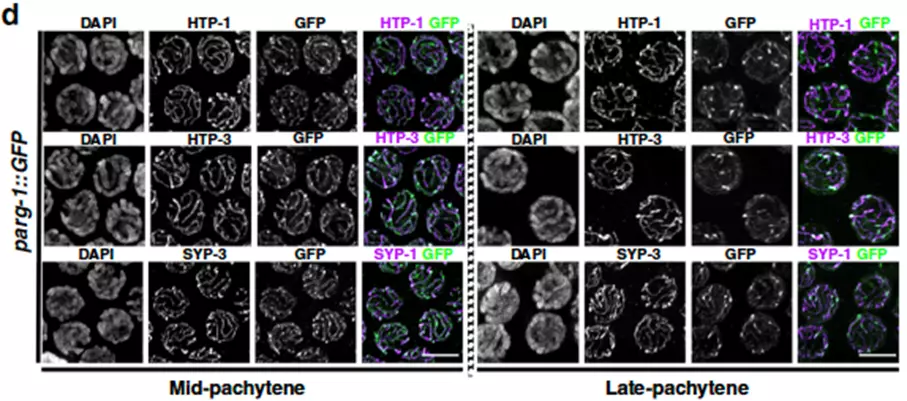
Obrázek 1. Vajíčka v uvedeném stadiu obarvené na různé podjednotky SC a PARG-1 (GFP). Janisiw a kol.; Nature Communications, 2020.
Výzkumníci si také všimli, že PARG-1 vytváří proteinové komplexy s proteiny zapojenými do indukce a zpracování meiotických dvouvláknových zlomů také u jiných druhů. Díky studiu C. elegans zjistili, že je PARG-1 je důležitý pro regulaci počtu zlomů DNA během vývoje zárodečných buněk a napomáhá jejich přesné opravě pomocí homologní rekombinace, viz Obrázek 2.
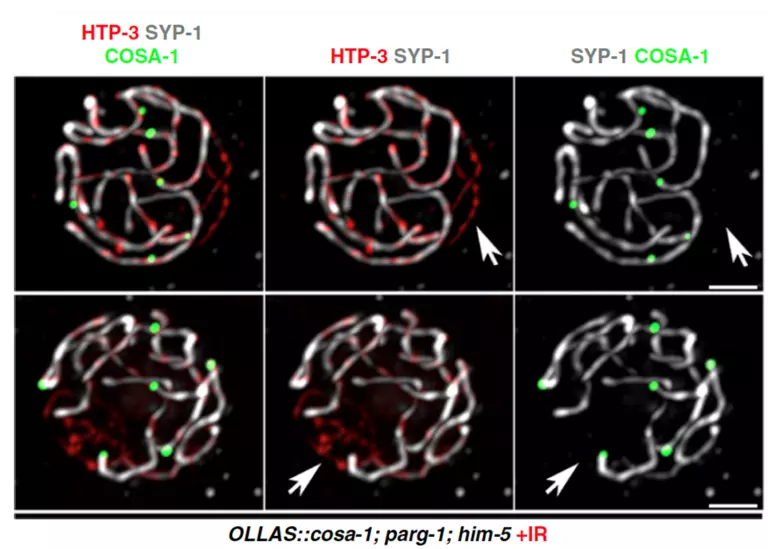
Obrázek 2. Vajíčka obarvená na různé podjednotky SC a místa crossoverů u mutantů se sníženým počtem DSB po ozáření.; Janisiw a kol.; Nature Communications, 2020.
Vědci také zjistili, že PARG-1 hraje díky schopnosti lokalizovat se podél chromozomů klíčovou roli při indukci dvouvláknových zlomů a homologní rekombinaci, což naznačuje, že nejenže vykonává enzymatické funkce, ale je důležitý i ze strukturního hlediska.
Výzkumníky také zajímala proteinová struktura, kterou PARG-1 a další proteiny vytváří v zárodečných buňkách. Tato analýza vedla k identifikaci fyzické a funkční interakce s komplexem BRC-1-BRD-1, který je u člověka homologem BRCA1-BARD1. Tyto proteiny hrají hlavní role při regulaci stability genomu v mitotických buňkách, avšak jejich funkce během meiózy je složitější. Výzkum odhalil, že současná odstranění PARG-1 a BRC-1 způsobí zvýšenou neplodnost v důsledku rozsáhlé nestability genomu. Zejména výzkumníci pozorovali, že mnoho DNA poškození vzniklých během meiózy nebylo správně opraveno, což vedlo k vytvoření fúzí chromozomů a sníženému množství rekombinací.
Při odstranění různých opravných drah DNA spolu s BRC-1/PARG-1 pozorovali výzkumníci zhoršující se integritu genomu způsobenou nedostatkem polymerázy POLQ-1, o které víme, že hraje roli při realizaci důležité opravné dráhy DNA nazývané alternative non-homologous end joining.
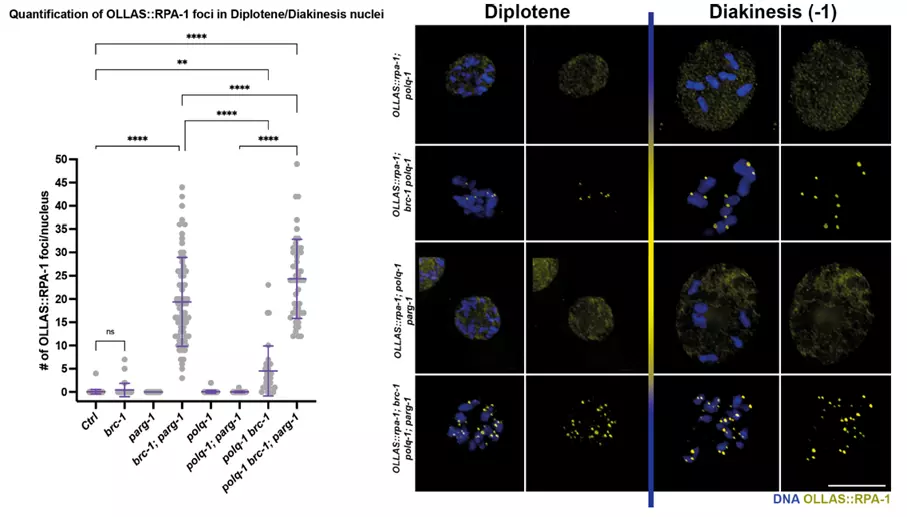
Obrázek 3. Vajíčka uvedeného genotypu a stádia obarvené na marker jednořetězcové DNA, který zvýrazňuje přítomnost neopraveného poškození v nepřítomnosti BRC-1-PARG-1.; Trivedi a kol.; Nucleic Acids Research, 2022.
Výzkum Nicola Silvy byl prvním in vivo důkazem, že při narušené funkci BRC-1/BRCA1 je aktivita PARG-1/PARG nezbytná pro zachování integrity genomu v gametách. Navíc jeho zjištění o letalitě vyvolané současným zrušením funkce POLQ-BRCA1 má obrovský význam pro léčbu rakoviny a je v souladu s nedávnými výzkumy, které u lidí vykazují slibné výsledky při cílení na nádorové buňky pomocí inhibitorů POLQ a mohly by sloužit jako nová cesta ke zlepšení léčebných výsledků u nádorů s mutacemi BRCA1. Jeho práce zdůrazňuje klíčovou roli, kterou modelové systémy hrají při analýze konzervovaných drah u jednodušších organismů.
Zdroj: Grantová agentura ČR
- Autor článku: ne







































