V pondělí 7. října 2024 byli Nobelovou cenou za fyziologii a medicínu oceněni Victor Ambros a Gary Ruvkun, dva američtí vědci, jenž se podíleli na objevu miRNA a její roli v regulaci genové exprese. Jak cenu vnímají čeští vědci, kteří se studiu miRNA věnují a proč je dobré používat červy jako modelový organismus?
© The Nobel Committee for Physiology or Medicine. Ill. Mattias Karlén
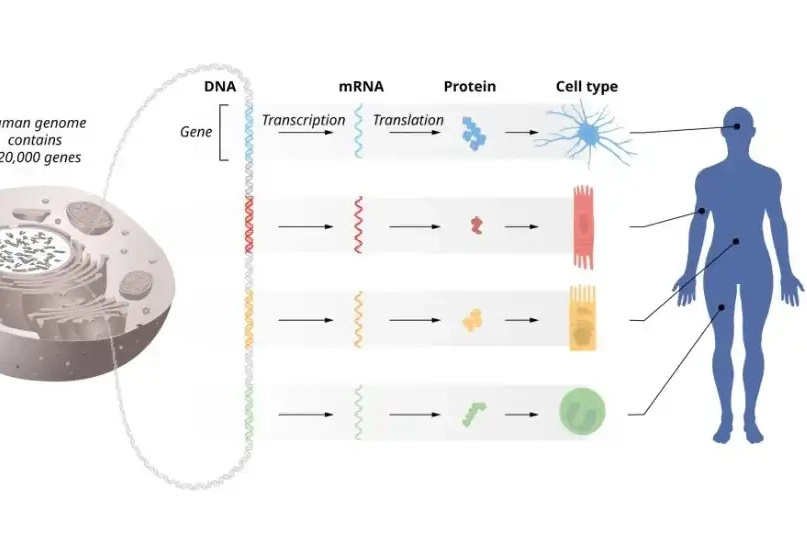
Když se mají v buňkách přepsat geny z DNA do proteinů, využívá se k tomu jako mezistupeň mRNA (messengerRNA). Tato jednovláknová nukleová kyselina vynese informaci o genech z jádra buňky do cytoplasmy, kde se podle ní vytvoří proteiny – ty, které tvoří naše svaly, nebo protilátky, hormony či enzymy.
Když vědci začali sekvenovat genomy různých organismů, včetně toho lidského, překvapilo je, jak málo genů ve skutečnosti DNA nese. Například u lidí nebyl počet kolem 20 000 genů ani zdaleka schopen vysvětlit veškerou rozmanitost, kterou mezi jednotlivci pozorujeme, stejně jako odlišnosti v různých buňkách v rámci jednoho organismu.
Postupně se odhalovalo množství regulačních mechanismů, které ovlivňují to, jaké geny a jak moc se budou přepisovat do podoby proteinů. Těmito regulacemi se dramaticky zvyšuje variabilita živého světa kolem nás. „Regulace genových aktivit probíhá na mnoha úrovních, nejen v jádře, kde se rozhoduje, kolik mRNA se z genu přepíše, ale také v cytoplasmě, kde se rozhoduje, kolik proteinu se z mRNA vyrobí a jak dlouho tam mRNA vydrží – a ukazuje se, že cytoplasmatické regulace jsou srovnatelně důležité, jako ty jaderné,“ popisuje Petr Svoboda, vedoucí Laboratoře epigenetických regulací na Ústavu molekulární genetiky AV ČR.
Jednu z cytoplasmatických regulací zajišťují právě miRNA (mikroRNA), které své označení získaly proto, že se jedná o krátké úseky RNA (typicky kolem dvaceti nukleotidů). miRNA jsou stejně jako mRNA kódovány v naší DNA, jsou z ní přepisovány a následně působí jako regulační elementy pro dlouhé řetězce mRNA. Na ty se v cytoplasmě buněk navážou a mohou tak zamezit jejich přepisu do podoby proteinů.
Skupina krátkých RNA v genomu je označována jako nekódující, tzn. že se podle nich nevytvoří proteiny, jejich role je ale obrovská. Letošní nobelisté Victor Ambros a Gary Ruvkun nejenom objevili první miRNA u modelového organismu C.elegans, (háďátko obecné), ale také popsali, jak mechanismus umlčování genů pomocí miRNA funguje. „První dva články obou nobelistů z časopisu Cell v roce 1993 nejprve vzbudily odborný zá jem pouze malé skupiny vědců, protože dotyčná miRNA (lin-4) byla přítomná jenom v haďátku. Průlom nastal v roce 2000, kdy byla objevena druhá miRNA – let-7, která je přítomná v buňkách všemožných živočichů včetně octomilky a člověka. Objev miRNA tak odhalil nečekanou a velmi významnou úroveň regulace genové exprese u živočichů a rostlin,“ dodává Petr Svoboda, jehož laboratoř se právě krátkými RNA a její rolí v regulaci genové exprese, například v myších zárodečných buňkách, věnuje.
„C.elegans projde během dvou dnů několika jasně definovanými vývojovými stádii, a právě miRNA hrají zásadní roli v jejich správném načasování. Jestliže má háďátko mutaci v genu pro lin-4 miRNA, ,zasekne‘ se v 1. larválním stádiu, které neustále opakuje, nikdy nedospěje. Mutace v genu pro miRNA let-7 zase vede ke smrti C.elegans tím, že jedinci s touto mutací v rané dospělosti ,explodují skrze vulvu‘ – vývoj jednotlivých tkání u nich totiž není synchronizovaný, vulva je vyvinuta dříve než okolní tkáně, které neudrží vnitřní pnutí a mechanicky se tak vnitřnosti vyvalí vulvou ven. Výsledkem je smrt dříve, než mohou zplodit potomky. U člověka exprese let-7 souvisí s načasováním puberty, při jejím nedostatku přichází puberta později,“ popisuje role obou zmíněných miRNA Jana Brunner, Češka, která se na prestižním Friedrich Miescher Institute for Biomedical Research (FMI) ve švýcarské Basileji zabývá mimo jiné studiem let-7 miRNA. Vedoucí její laboratoře Helge Grosshans se zná nejen s oběma nobelisty, ale shodou okolností letos získal prestižní švýcarský grant právě na studium lin-4 miRNA. Jeho laboratoř tak doufá, že se díky Nobelově ceně podaří na téma nalákat špičkové vědce a studenty.
Dnes už jsou popsány desítky tisíc miRNA u 271 druhů rostlin a živočichů, dokonce i u některých virů. Tyto malé RNA hrají roli jak při vývoji jednotlivých organismů, tak právě při diferenciaci jednotlivých typů buněk. Také díky nim tak mohou jednotlivé buňky se stejnou DNA plnit rozdílné úlohy.
Objev miRNA tak odhalil jednu obrovskou kapitolu molekulární biologie, která ještě rozhodně není dopsaná do konce. „V posledních letech spolupracujeme s Richardem Šteflem z CEITECu a snažíme se pochopit, jak miRNA vzniká a jak se po svém vzniku miRNA naváže na Argonaut protein. Ten je klíčový pro celý proces. Přestože 20 let víme, že miRNA je nejprve v cytoplasmě navázaná na Argonaut protein, což vytváří základ komplexu, který se následně naváže a zablokuje mRNA, pořád neznáme molekulární mechanismus, který miRNA vybere a do Argonautu posadí – je to víceméně poslední nedořešená velká otázka oboru a my bychom u toho chtěli být,“ popisuje svůj další výzkumný záměr Petr Svoboda, který se vedle studií na myších začal zabývat také slimáky a snaží se popsat všechny malé RNA a mechanismy jejich vývoje během evoluce u měkkýšů (psali jsme zde).
Proč studovat červy?
Nobelova cena byla v tomto roce udělena za objev učiněný na modelovém organismu C.elegans, tedy háďátku obecném. Jedná se o drobného nepatogenního červa žijícího volně v půdě. Jeho výhodou je nejen zmíněný krátký vývojový cyklus – během dvou dnů se vyvine z embrya až v dospělce, ale také jasně definovaný a stálý počet jeho buněk. „C. elegans je nejvíce používaný modelový organismus ve vývojové biologii, jelikož již od prvotních stádií jeho vývoje známe dopředu osud každé buňky. Můžeme tak přesně sledovat, kde se v průběhu vývoje udála případná pozorovaná změna. Díky velkému množství zavedených molekulárních metod, rychlému vývoji a snadné manipulaci tak háďátko funguje jako molekulární hřiště, na němž můžeme zkoušet nové molekulárně-biologické postupy,“ popisuje výhody práce s háďátky Jana Brunner.
Letošní Nobelova cena je již čtvrtá, která byla udělena za objevy učiněné na C.elegans. První dvě byly za fyziologii a medicínu: v roce 2002 za objev genetické regulace vývoje a programované buněčné smrti. V roce 2006 za RNA interferenci, příbuzný mechanismus miRNA, jež primárně funguje jako obrana proti virovým infekcím. „Když byla v roce 2006 udělena cena za RNA interferenci, bylo tehdy trochu překvapením, že ji společně s oceněnými vědci nedostal nikdo za miRNA, a ani nikdo z výzkumu rostlin, kde byl stejný fenomén pozorovaný dříve, zejména se čekalo, že by to mohl být David Baulcombe. Roky se tak spekulovalo, jestli nebude za miRNA udělena druhá Nobelova cena. Loni jsem zaznamenal, že Victor Ambros byl mezi zmíněnými potenciálními kandidáty, letos to vyšlo. Kdyby to s nimi dostal i David Baulcombe, asi by to nikoho nepřekvapilo, protože výzkum příbuzných mechanismů na rostlinách probíhal ve stejné době a byl inspirací i pro ty, kdo pracovali s živočichy,“ doplňuje Svoboda, který se s Victorem Ambrosem před měsícem na konferenci v Kodani domluvil, že dorazí příští rok jako jeden z přednášejících na konferenci do Prahy. Uvidíme tedy, zda přijede i v pozici nobelisty.
Třetí Nobelova cena udělena za výzkum na háďátku byla v roce 2008 za chemii, za objev a výzkum zeleného fluorescenčního proteinu GFP. „Další obrovskou výhodou C.elegans je, že má transparentní tělo, tím pádem můžeme přesně sledovat všechny vývojové procesy v reálném čase v živém organismu. Když použijeme fluorescenční protein a označíme si pomocí něj jakýkoliv gen, můžeme potom pod mikroskopem jeho expresi přesně sledovat v jednotlivých buňkách, aniž bychom museli háďátko usmrtit nebo s ním nějak složitě manipulovat,“ uzavírá výčet výhod použití vývojově jednodušších modelových organismů Jana Brunner.
Autorka: Vendula Lužná (Vědavýzkum.cz)
- Autor článku: ano
- Zdroj: Vědavýzkum.cz









































