Přesně tak by se dala s humorem popsat jedna spolupráce neuroonkologa Michala Zápotockého s kanadskými kolegy. I když se ze zahraničí před dvěma roky vrátil a působí jako vědec a lékař znovu v Česku, spolupráce se zahraničím pokračují a výsledkem je i publikace v jednom z nejprestižnějších vědeckých časopisů Cell.

Tým Prague Brain Tumour Research Group: zleva – Miroslav Koblížek, David Sumerauer, Lenka Krsková, Aleš Vícha, Michal Zápotocký, Kateřina Váňová, Adéla Mišove a Josef Zámečník (archivní foto).
Na publikaci se mimo Zápotockého podílelo i pět kolegů a kolegyní z 2. lékařské fakulty UK a FN Motol.
„V rámci kanadského fellowshipu v letech 2015 až 2018 jsem na svých projektech spolupracoval s výzkumnými skupinami po celé Kanadě, včetně profesorky Nady Jabado z McGill University v Montrealu, která se dlouhodobě zabývá biologií tzv. high-grade gliomů (HGG – rychle rostoucí nádory mozku – pozn. redakce) a její skupina byla první, která popsala mutace v genu pro histon 3 u dětských pacientů s HGG,“ popisuje začátek příběhu Michal Zápotocký a hned dodává, že v rámci výzkumu dětských mozkových nádorů vládne v Kanadě velmi přátelská atmosféra.
„V roce 2018 uspořádala profesorka Jabado symposium Current Updates in Neural Therapies, které bylo součástí rozlučky se svobodou mého kamaráda a spolupracovníka Vijaye Ramaswamyho z Toronta. A právě zde jsme se s profesorkou Jabado domluvili na pokračující spolupráci i po mém návratu do Prahy,“ vysvětluje vznik spolupráce na studii, která byla ned ávno publikována v Cell a jež se zabývá biologií jednoho podtypu HGG s histon 3 mutací – H3F3A G34R/V.
ávno publikována v Cell a jež se zabývá biologií jednoho podtypu HGG s histon 3 mutací – H3F3A G34R/V.
Michal Zápotocký spolu s kolegy a kolegyněmi z Kliniky dětské hematologie a onkologie a Ústavu patologie a molekulární medicíny 2. LF a FN Motol v rámci výzkumné skupiny Prague Brain Tumour Research Group charakterizují dětské pacienty s HGG. Z kohorty 80 pacientů identifikovali 30 pacientů s mutací v genu pro histon 3, z čehož čtyři měli právě variantu H3F3A G34R/V (zbývající pacienti měli jiné mutace).
„V rámci spolupráce jsme poskytli sekvenační data a data z methylační array. Dále jsme měli k dispozici čerstvě zmraženou tkáň tumorů od těchto pacientů, kterou jsme týmu profesorky Jabado také poskytli. Na těchto vzorcích bylo provedeno Single-Cell RNA sekvenování (scRNAseq) – technologie, která umožňuje posouzení transkriptomu na úrovni jedné buňky. Toho se využívá k určení jednotlivých buněčných subpopulací v tumoru, určení buňky původu a dalších informací,“ popisuje Zápotocký mezinárodní spolupráci, která je při výzkumu dětských nádorových onemocnění běžná. Konkrétním podtypem nádorového onemocnění totiž často trpí jen několik málo jedinců, a proto se vzorky pro výzkum sbírají opravdu po celém světě. „Celkem publikovaný soubor obsahoval přes sto pacientů s mutací H3F3A G34R/V, ale pouze u šestnácti byla k dispozici tkáň vhodná k scRNAseq, takže naše vzorky představovaly čtvrtinu tkání vyšetřených pomocí scRNAseq,“ udává konkrétní čísla.
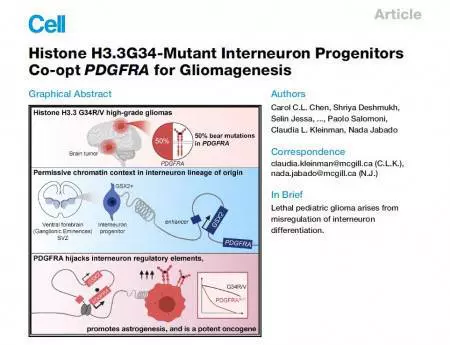 „Nejzajímavějším a zároveň hlavním zjištěním studie je, že buňkou původu u gliomů s mutací H3F3A G34R/V je GSX2 pozitivní prekurzor kortikálního interneuronu (gliomy jsou nádorová onemocnění gliových buněk, což jsou podpůrné buňky, které spolu s neurony tvoří nervový systém – pozn. redakce). Přítomnost této mutace způsobuje zablokování diferenciace tohoto prekurzoru a současná pozměněná exprese signální molekuly PDGFRalfa vede ke spuštění astrocytárních transkripčních programů, a proto dochází k rozvoj gliálního nádoru z prekurzoru pro neuron,“ shrnuje neuroonkolog překvapivý výsledek, kdy gliom (nádorové onemocnění gliových buněk) vzniká z neuronálního prekurzoru. Druhým nečekaným výsledkem je kromě pozměněné exprese signální molekuly PDGFRalfa i její netypická mutace, která má vliv na další signalizaci (aktivuje MAPK dráhu), a to by mohlo být využito i terapeuticky (například známá léčiva MAPK ihibitory).
„Nejzajímavějším a zároveň hlavním zjištěním studie je, že buňkou původu u gliomů s mutací H3F3A G34R/V je GSX2 pozitivní prekurzor kortikálního interneuronu (gliomy jsou nádorová onemocnění gliových buněk, což jsou podpůrné buňky, které spolu s neurony tvoří nervový systém – pozn. redakce). Přítomnost této mutace způsobuje zablokování diferenciace tohoto prekurzoru a současná pozměněná exprese signální molekuly PDGFRalfa vede ke spuštění astrocytárních transkripčních programů, a proto dochází k rozvoj gliálního nádoru z prekurzoru pro neuron,“ shrnuje neuroonkolog překvapivý výsledek, kdy gliom (nádorové onemocnění gliových buněk) vzniká z neuronálního prekurzoru. Druhým nečekaným výsledkem je kromě pozměněné exprese signální molekuly PDGFRalfa i její netypická mutace, která má vliv na další signalizaci (aktivuje MAPK dráhu), a to by mohlo být využito i terapeuticky (například známá léčiva MAPK ihibitory).
„Znalost buňky původu a další charakteristiky jednotlivých nádorových onemocnění umožňuje přesnější modelování daného onemocnění a tím i efektivnějšího testování potenciálních léků a hledání nových způsobů léčby,“ vysvětluje širší význam této studie Michal Zápotocký. Ve svých výzkumných projektech se i díky výzkumné podpoře Primus UK a nadaci 1000 statečných věnuje například lepší diagnostice jednotlivých podtypů HGG.
„Zjistili jsme, že u některých mutací nejsme schopni vyléčit žádného pacienta. Jiné podtypy sice pod mikroskopem vypadají jako HGG, ale biologicky se chovají spíše jako pomalu rostoucí gliomy, které by bylo možné léčit méně intenzivní a specifickou terapií,“ shrnuje, proč je důležité lépe porozumět jednotlivým podtypům HGG a nalézt způsoby, jak je jednoduše diagnosticky odlišit.
 Další výzkumnou otázkou například zůstává, kdy mutace v genu pro histon 3 vznikají – již prenatálně? Pokud ano, co způsobuje, zda a kdy se u pacienta nádorové onemocnění rozvine a dalo by se tomu preventivně zabránit? Na to třeba jednou odpoví některý z budoucích výzkumů.
Další výzkumnou otázkou například zůstává, kdy mutace v genu pro histon 3 vznikají – již prenatálně? Pokud ano, co způsobuje, zda a kdy se u pacienta nádorové onemocnění rozvine a dalo by se tomu preventivně zabránit? Na to třeba jednou odpoví některý z budoucích výzkumů.
Autorka: Pavla Hubálková
Foto: archiv M. Zápotockého, Vladimír Šigut
Článek vyšel v online magazínu Univerzity Karlovy Forum.
- Autor článku: ne
- Zdroj: Univerzita Karlova











































