Výzkum bioterapeutik představuje slibný přístup k léčbě závažných onemocnění. Hlavní složkou jsou biologické látky jako například proteiny, které jsou upraveny tak, aby se zaměřily na konkrétní aspekty nemoci.

Vědci z ČVUT na konferenci ve Vídni, 7. 5. 2024 – zleva doprava: Jiří Sedlář, Petr Kouba, Roman Bushuiev, Anton Bushuiev, Josef Šivic.
Významný přínos v této oblasti hlavně pro léčbu cévní mozkové příhody učinil tým Josefa Šivice z CIIRC ČVUT, zejména vědci Anton a Roman Bushuievovi, ve spolupráci s týmem Stanislava Mazurenka z Loschmidtových laboratoří Masarykovy univerzity (MU) a Mezinárodního centra klinického výzkumu (ICRC) a týmem Tomáše Pluskala z Ústavu organické chemie a biochemie (ÚOCHB) AV ČR. Jejich nová metoda s názvem PPIformer využívá strojové učení pro efektivnější návrh proteinů s vylepšenými interakčními vlastnostmi, čímž se otevírá cesta pro výrazné urychlení vývoje nových léků proti mozkové mrtvici i pro léčbu dalších onemocnění. Výsledky výzkumu vědci prezentovali na jedné z nejvýznamnějších světových konferencí strojového učení ICLR 2024 začátkem května ve Vídni.
Bioterapeutika na rozdíl od tradičních léků mohou spolupracovat s imunitním systémem nebo jinými biologickými procesy, a tím rozpoznat a léčit nemoc. Jsou jimi často enzymy, protilátky nebo dokonce buňky, které ale vyžadují úpravu pro zlepšení biologické účinnosti a stability.
Anton Bushuiev na ICLR ve Vídni, 7. 5. 2024.
Vědci se zaměřili na vývoj vylepšené verze proteinu stafylokinázy, který se již osvědčil při rozpouštění krevních sraženin v trombolytických léčivech podávaných při mozkové mrtvici. Mrtvice může mít závažné a dlouhodobé následky, včetně ochrnutí, problémů s řečí a jazykem, ztráty paměti a emočních potíží. Její dopady se mohou značně lišit v závislosti na závažnosti mrtvice a rychlosti poskytnuté léčby. Široké klinické použití stafylokinázy je ale v současné době limitované její slabou interakcí s plazminem, proteinem přítomným v lidské krvi.
„Zaměřili jsme se na vylepšení stafylokinázy pomocí výměny jejích specifických stavebních kamenů – aminokyselin, které jsou zodpovědné za tyto interakce,” vysvětluje Josef Šivic z CIIRC ČVUT a dodává: „Abychom identifikovali aminokyseliny nejvhodnější pro taková nahrazení, natrénovali jsme výpočetní neuronový model, který je schopen se učit z velkého množství příkladů, podobně jako je to již běžné v jiných oborech, například při zpracování přirozeného jazyka systémy jakou jsou ChatGPT. Systém dokáže předpovídat účinek takové změny, tedy jak změny v aminokyselinách následně ovlivní interakce mezi proteiny.”
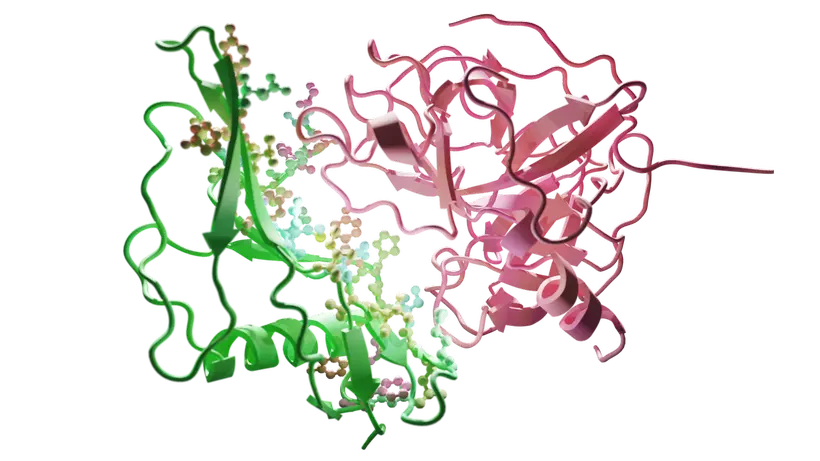
Interakce biologické molekuly stafylokinázy (vlevo/zelená) s proteinem plazminem (vpravo/červená) přítomným v lidské krvi. Aminokyseliny stafylokinázy zodpovědné za interakci jsou znázorněny malými kuličkami v různých barvách.
Existují miliony možných způsobů, jak modifikovat aminokyseliny bílkovin. „Tradiční způsob nalezení těch nejvhodnějších úprav pro zlepšení interakce léčiva by vyžadoval rozsáhlé a časově náročné experimenty,” upozorňuje Tomáš Pluskal z ÚOCHB AVČR. Identifikace těchto záměn aminokyselin má velký praktický význam i pro další úlohy související s interakcí proteinů, například pro návrh nových vakcín a biosenzorů.
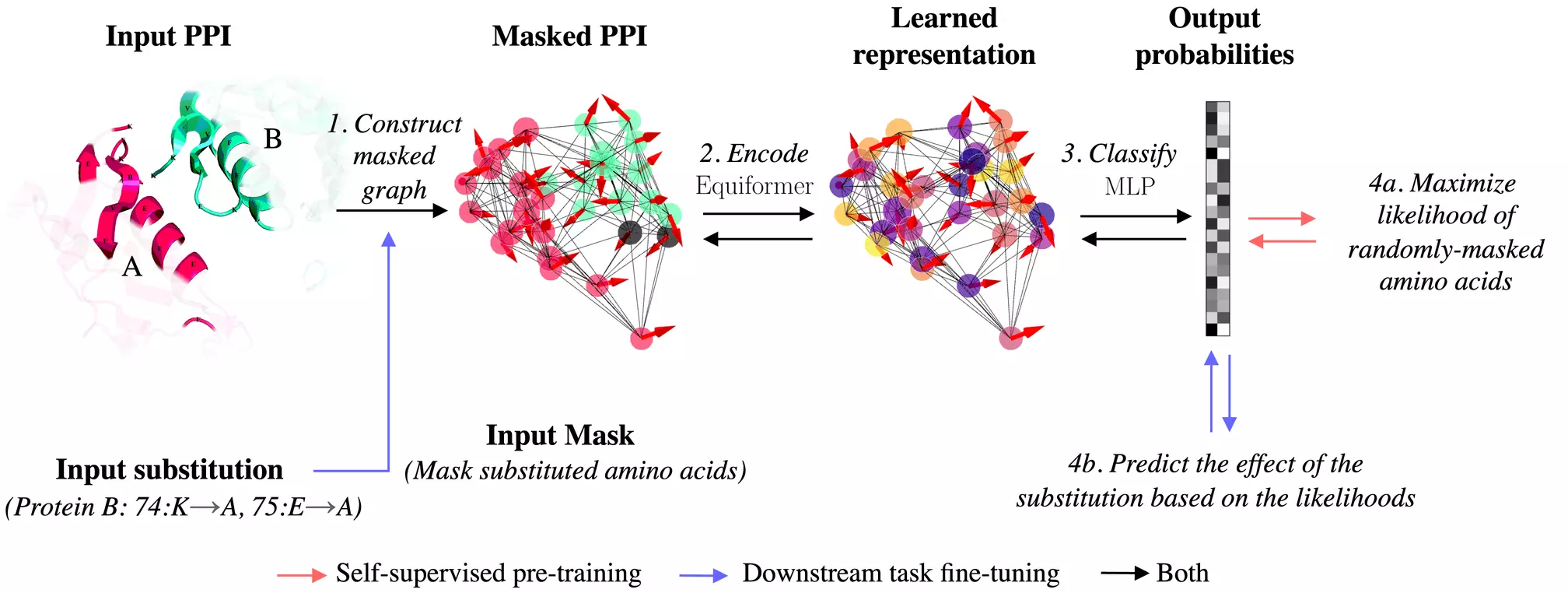
Navržená metoda nazvaná PPIformer umožňuje předpovídat účinky aminokyselinových záměn na protein-proteinové interakce (PPI) ve zlomku sekundy. Metoda PPIformer je založena na strojovém učení, které implementuje takzvané „self-supervised“ učení, kdy je model schopen sám se učit z dat bez nutnosti dalších anotací.
„To znamená, že PPIformer nevyžaduje nákladné a časově náročné laboratorní experimenty. Místo toho se spoléhá na námi nově shromážděný a v současnosti největší soubor dat protein-proteinových interakcí, získaných z veřejně dostupných struktur proteinů,” objasňuje Stanislav Mazurenko z Loschmidtových laboratoří MU.
Ilustrace navržené metody, která využívá jako vstup interakci proteinů spolu s cílovou záměnou (vlevo) a předpovídá účinek záměny na základě předpovězených pravděpodobností možných aminokyselin (vpravo).
PPIformer byl nejprve trénován na předpovídání aminokyselin zamaskovaných ve známých strukturách protein-proteinových interakcí. Princip je podobný jako u rozsáhlých jazykových modelů, např. ChatGPT, které jsou trénovány na předpovídání slov ve větách.
„Po učení z milionů automaticky vytvořených trénovacích příkladů maskovaných aminokyselin byl model dotrénován na malé datové sadě obsahující substituce aminokyselin anotovaných na základě laboratorně naměřených dat,“ říká doktorand a hlavní autor metody Anton Bushuiev z CIIRC ČVUT.
Vyvinutá metoda, popsaná v článku „Learning to design protein-protein interactions with enhanced generalization”, prokázala vysoký potenciál při identifikaci příznivých mutací ve stafylokináze a také v lidské protilátce proti koronaviru SARS-CoV-2.
Návrhy vylepšené stafylokinázy jsou v současné době experimentálně ověřovány v Loschmidtových laboratořích MU a v Mezinárodním centru klinického výzkumu Fakultní nemocnice u sv. Anny v Brně a Lékařské fakulty MU. Dále bude tým ve spolupráci s Mezinárodním centrem pro výzkum neurodegenerativních poruch (INDRC) rozšiřovat tento přístup na biomolekuly, které se podílejí na neurodegenerativních onemocněních.
Nově vyvinutá metoda strojového učení byla přijata na konferenci ICLR 2024 (The Twelfth International Conference on Learning Representations). ICLR je jednou ze tří nejdůležitějších konferencí v oblasti strojového učení (spolu s konferencemi NeurIPS a ICML) a podle Google Scholar patří mezi deset nejvlivnějších časopisů a konferencí ve všech oblastech vědy.
Odborný článek: A. Bushuiev, R. Bushuiev, P. Kouba, A. Filkin, M. Gabrielova, M. Gabriel, J. Sedlar, T. Pluskal, J. Damborsky, S. Mazurenko, J. Sivic, Learning to design protein-protein interactions with enhanced generalization, International Conference on Learning Representations (ICLR), 2024. https://doi.org/10.48550/arXiv.2310.18515
- Autor článku: ne
- Zdroj: České vysoké učení technické v Praze