
Čeští a němečtí biologové objevili nový protein, který je klíčový pro propojení parazitického prvoka a bakterie. Jejich objev pomůže v budoucnu vědcům lépe pochopit, jak na buněčné úrovni vznikla spolupráce mezi různými organismy.
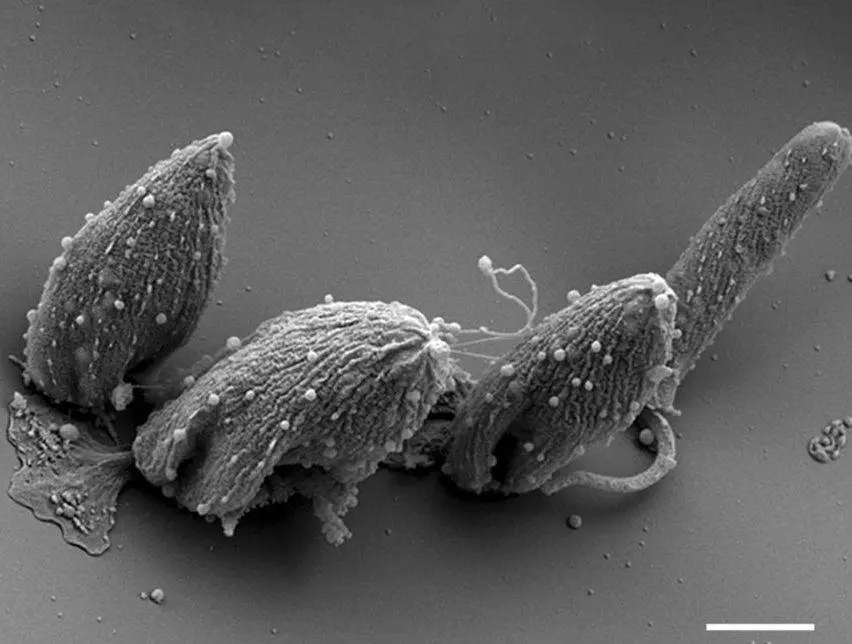
Prvok Novymonas esmeraldas, patřící do skupiny trypanosomatidů, je nejbližším příbuzným prvoků z rodu Leishmania, jehož zástupci způsobují nemoci lidí i zvířat (např. leishmaniózu, známou také jako aleppské či bagdádské vředy). Tým profesora Jurčenka se trypanosomatidy zabývá dlouhodobě. Právě tento nepatogenní prvok (Novymonas esmeraldas) se do pozornosti ostravských vědců dostal již před několika lety, když v jeho buňce objevili bakterii Pandoraea novymonadis. Tato bakterie s ním koexistuje v symbióze a dodává mu nejrůznější potřebné i užitečné látky (vitamíny, aminokyseliny aj.), přičemž prvok bakterii „na oplátku“ poskytuje ochranu a živiny.
Biologové Přírodovědecké fakulty Ostravské univerzity (PřF OU) spolu s kolegy z Parazitologického ústavu Biologického centra Akademie věd ČR a kolegy z německé Heinrich Heineuniverzity z Düsseldorfu teď objevili nový protein TMP18e, který je klíčový právě pro spojení mezi prvokem a bakterií.
„Tento protein vznikl duplikací běžného transmembránového proteinu, který se vyskytuje u řady trypanosomatidů a jehož funkce nám dosud zůstává neznámá. Nový protein TMP18e pomáhá tomu, aby bakterie byla blízko jádra buňky prvoka, kde se nachází dědičná informace DNA. To je důležité při množení buněk a s ním korespondující množení bakterií. Na základě našich experimentů se ukázalo, že bez proteinu TMP18e bakterie sice zůstala uvnitř buňky, ale vzdálila se od jádra. Celý proces dělení by tak bez proteinu nefungoval a nové buňky by nejspíše neměly žádnou bakterii, což by mohlo vyústit v nefunkční buňku prvoka, která by od bakterie nezískávala potřebné látky,“ vysvětluje Vjačeslav Jurčenko z PřF OU.
Objev mezinárodního vědeckého týmu publikovaný v prestižním časopise Current Biology má jeden významný přesah. Může pomoci pochopit, jak vznikala spolupráce mezi různými druhy jednobuněčných organismů, a jak se v rámci historického vývoje tato spolupráce odráží v jejich proměně (ve stavbě, chování či dědičnosti). Provázanost prvoka Novymonas esmeraldas a bakterie Pandoraea novymonadis nám objevem proteinu naznačuje možné mezistupně endosymbiózy i to, jak mohla probíhat v historii.
„Náš objev proteinu TMP18e nás zpětně posouvá k pochopení funkce běžně se vyskytujícího transmembránového proteinu TMEM18 a dalších podobných proteinů v prvocích, kteří hostí rozličné endosymbionty. Právě proto chceme tyto proteiny dále studovat, čímž můžeme nejen pochopit jejich funkci, ale také odkrýt, jaké podmínky musí být splněny, aby docházelo k efektivní endosymbióze a potenciálně i získat poznatky uplatnitelné v praxi,“ uzavírá profesor Jurčenko.
Zdroj: Ostravská univerzita
- Autor článku: ne
- Zdroj: Ostravská univerzita








































